Chers amis, nous poursuivons l’année par une mise au point sur l’artérite à cellules géante (ACG aussi connue sous le nom de maladie de Horton). L'ACG est une vascularite systémique chronique qui touche les artères de moyen et gros calibres, le plus souvent les artères temporales et autres artères crâniennes, mais aussi la jonction axillo-sous-clavière et l’aorte abdominale. Une corticothérapie orale à dose élevée de pendant plusieurs semaines suivies d'une réduction graduelle est actuellement le traitement de première intention. Plusieurs publications ces dernières années proposent de nouvelles possibilités thérapeutiques dont le tocilizumab (RoActemra®).
- Essai clinique du Tocilizumab dans l’artérite à cellules géantes, publié en 2017 dans le New England Journal of Medicine.
- Le Tocilizumab comme traitement d'appoint aux corticoïdes pendant les 3 premiers mois du traitement de l'artérite à cellules géantes : une étude prospective publiée en 2018 dans le Journal uropéen de médecine interne.
- Tocilizumab et maladie de Horton : étude ouverte, observationnelle chez 134 patients en pratique quotidienne publiée en 2019.
Essai clinique du Tocilizumab dans l’artérite à cellules géantes
J.H. Stone, K. Tuckwell, S. Dimonaco, M. Klearman, M. Aringer, D. Blockmans, E. Brouwer, M.C. Cid, B. Dasgupta, J. Rech, C. Salvarani, G. Schett, H. Schulze‑Koops, R. Spiera, S.H. Unizony, and N. Collinson et al. Trial of Tocilizumab in Giant-Cell Arteritis. N Engl J Med 2017; 377:317-328
Lien : https://www.nejm.org/doi/full/10.1056/NEJMoa1613849
DOI : 10.1056/NEJMoa1613849
INTRODUCTION
L’artérite à cellules géantes (ACG) rechute souvent lors de la décroissance des corticoïdes, et leur utilisation prolongée est associée à des effets secondaires. Les thérapies d'appoint ciblant des voies pathogènes possibles comme celle de l'interleukine 6 (IL-6) peuvent aider à contrôler les symptômes et la progression de la maladie et à réduire l'utilisation des corticoïdes. Le tocilizumab (TCZ), un antagoniste des récepteurs de l'IL-6, est ainsi testé chez des patients présentant une ACG.
METHODES
Au cours de cet essai d'un an, 251 patients ont été randomisés en 4 bras :
- TCZ en injection sous-cutané (SC) (à une dose de 162 mg) toutes les semaines en association avec une décroissance des corticoïdes pendant 26 semaines (n=100) ;
- TCZ en SC (à une dose de 162 mg) toutes les 2 semaines en association avec une décroissance des corticoïdes pendant 26 semaines (n=50) ;
- Placebo en SC toutes les semaines en association avec une décroissance de corticoïdes pendant 26 semaines (n=50) ;
- Placebo en SC toutes les semaines en association avec une décroissance de corticoïdes pendant 52 semaines (n=51).
Le critère de jugement principal était le taux de rémission sans corticoïdes à la semaine 52 dans chaque groupe tocilizumab, comparativement au taux observé dans les groupes placebo.
La poussée de la maladie a été définie comme : la réapparition de signes ou de symptômes d'ACG ou l’augmentation de la vitesse de sédimentation (VS) ≥ 30 mm/heure attribuée à l'ACG.
La rémission était définie par un taux de CRP < 10 mg/L à la 12ème semaine, l'absence de poussée de la maladie pendant les semaines 12 à 52 et l'adhésion au traitement par la prednisone.
RESULTATS
Quatre-vingt-six pour cent (n=216) des patients ont terminé l’étude et le suivi à 52 semaines. Une rémission persistante à la semaine 52 a été observée chez 56 % des patients traités par TCZ toutes les semaines et chez 53 % de ceux traités par TCZ toutes les deux semaines, comparativement à 14 % des patients du groupe placebo qui ont reçu la prednisone pendant 26 semaines et 18 % de ceux du groupe placebo qui ont reçu la prednisone pendant 52 semaines (p < 0,001 entre TCZ et placebo et 26 semaines de corticoïdes). A noter l’absence de supériorité du bras TCZ toutes les 2 semaines vs placebo et 52 semaines de corticoïdes.
La dose médiane cumulée de prednisone sur 52 semaines était de 1 862 mg dans chaque groupe tocilizumab, comparativement à 3 296 mg dans le groupe placebo et 26 semaines de prednisone et 3 818 mg dans le groupe placebo et 52 semaines de prednisone.
Des effets indésirables graves sont survenus chez 15 % des patients du groupe ayant reçu du TCZ toutes les semaines, 14 % de ceux ayant reçu TCZ toutes les deux semaines, 22 % de ceux du groupe placebo avec 26 semaines de prednisone et 25 % de ceux du groupe placebo avec 52 semaines de prednisone.
CONCLUSION
Le TCZ administré en sous-cutané une fois par semaine ou toutes les deux semaines, en association avec une corticothérapie dégressive sur 26 semaines, est supérieur à la corticothérapie seule dégressive sur 26 semaines en prévention des rechutes.
Dans cette étude, bien que les neutropénies associées au TCZ aient été plus élevées, les taux d'infection étaient semblables.
L'étude a démontré que le TCZ en SC en continu toutes les 1 à 2 semaines augmentait le taux de rémission et réduisait l'utilisation des corticoïdes chez les adultes atteints d'ACG.
Un suivi plus long est nécessaire pour déterminer la persistance de la rémission et l'innocuité du TCZ, et également la persistance de la rémission à l’arrêt du TCZ. Ces résultats constituent la base d’approbation du TCZ dans l’ACG par la FDA.
Le Tocilizumab comme traitement d'appoint aux corticoïdes pendant les 3 premiers mois du traitement de l'artérite à cellules géantes : une étude prospective.
Samson, M., Devilliers, H., Ly, K. H., Maurier, F., Bienvenu, B., Terrier, B., et al. (2018). Tocilizumab as an add-on therapy to glucocorticoids during the first 3 months of treatment of Giant cell arteritis : A prospective study. Eur. J. Intern. Med. 57, 96–104. doi:10.1016/j.ejim.2018.06.008.
Lien : https://www.sciencedirect.com/science/article/pii/S0953620518302401?via%3Dihub
DOI : https://doi.org/10.1016/j.ejim.2018.06.008
INTRODUCTION
A la suite des premiers travaux ayant montré l’intérêt du tocilizumab dans la prise en charge de l’artérite à cellules géantes (ACG), les modalités de l’utilisation de cet anticorps humanisé anti récepteur de l’interleukine 6 restent à préciser (Loricera et al., 2015; Unizony et al., 2012; Villiger et al., 2016). Dans l’étude GiACTA Stone et al. (Stone et al., 2017) également présenté dans cette newsletter a montré l’efficacité du tocilizumab pour le maintien en rémission de l’ACG sans rapporter de données post-traitement. L’objectif de ce travail était donc d’évaluer en plus de son efficacité, le maintien ou non de la rémission au-delà de l’arrêt du traitement par tocilizumab.
METHODES
Cet essai multicentrique prospectif contrôlé en ouvert a inclus des patients avec ACG définie par les critères de l’ACR 1990 et biopsie temporale positive ou mise en évidence d’une aortite, définie par l’épaississement ≥ 3 mm de la paroi aortique ou un signal intense et homogène en tomographie par émission de positons. Le tocilizumab (TCZ) était administré sur une période de 3 mois en plus de la prednisone à 0,7 mg/kg/j à l’inclusion puis baissée progressivement, et en plus de l’aspirine (75-250 mg). Le critère d’évaluation principal était défini par le pourcentage de patients en rémission à 6 mois avec prednisone < 0,1mg/kg/j et 3 mois d’arrêt du TCZ. Les critères secondaires étaient le pourcentage de rémission et la tolérance après 12 mois de suivi.
RESULTATS
Vingt patients d’âge médian 72 ans ont été inclus. La rémission a été obtenue dans tous les cas à 3 mois et pour 75% des patients à 6 mois. Au cours du suivi, 10 patients (50%) ont présenté une rechute. Soixante-quatre évènements indésirables affectant 18 patients ont été rapportés, dont 1 décès de cause inexpliquée, 15 infections non sévères et 8 hypercholestérolémies.
CONCLUSION
Si le résultat principal montre l’intérêt d’adjoindre à la corticothérapie une courte utilisation (3 mois) du TCZ en début de traitement pour obtenir une rémission dans l’ACG, les auteurs soulignent le taux élevé de rechute (50%) après l’arrêt du traitement. Par ailleurs, 18 des 20 patients ont présenté un événement indésirable au cours de l’étude. Bien sûr, le faible nombre de patients est la principale limite de ce travail. En conclusion, l’arrêt du traitement par tocilizumab précoce reste délicat en raison du risque élevé de rechutes.
Tocilizumab et maladie de Horton : étude ouverte, observationnelle chez 134 patients en pratique quotidienne.
Calderón-Goercke M, Loricera J, Aldasoro V, Castañeda S, Villa I, Humbría A, et al. Tocilizumab in giant cell arteritis. Observational, open-label multicenter study of 134 patients in clinical practice. Semin Arthritis Rheum. 2019 Aug ;49(1):126–35.
INTRODUCTION
Le tocilizumab (TCZ) a démontré son efficacité dans deux essais randomisés dans le cadre de l’ACG. Dans ces deux essais, le diagnostic d’ACG était le plus souvent récent et les durées de traitement et de suivi courtes. Le TCZ en "vie réelle" serait utilisé principalement pour des patients réfractaires aux corticoïdes, avec des diagnostics non récents ou des patients présentant des effets secondaires dûs aux corticoïdes ou à leurs comorbidités. L'objectif de l'étude est de mesurer l'efficacité et la sécurité du TCZ dans l’ACG dans des conditions de pratique clinique courante avec des patients réfractaires aux corticoïdes ou présentant des effets secondaires importants.
METHODES
Il s'agit d'une étude observationnelle, rétrospective, ouverte et multicentrique. Les critères diagnostiques d’ACG étaient ceux de l'ACR 1990. Le TCZ était administré de façon intraveineuse (IV) ou sous-cutanée (SC), prescrit pour une ACG réfractaire au traitement par corticoïdes plus ou moins immunosuppresseurs conventionnels ou pour des effets indésirables des traitements. La rechute était définie par l'augmentation de la CRP ou de la VS. Cette recherche n'a pas reçu de financements de l'industrie pharmaceutique.
RESULTATS
Cent trente-quatre patients ont été inclus, d’âge moyen 73 ± 9 ans. La biopsie d'artère temporale était positive dans 61,5% des cas. Le délai médian entre le diagnostic et le début du TCZ était de 13,5 mois. Tous les patients avaient bénéficié d'un traitement par corticoïdes et 73,1% d'entre eux d’un traitement immunosuppresseur (n=98), le plus fréquent étant le méthotrexate (n=94). Trois patients avaient bénéficié d'une biothérapie.
Le TCZ était mis en place pour une maladie réfractaire chez 64,2% des patients (n=86) et pour des effets indésirables chez 35,8% (n=48). La dose de TCZ initiale était de 8mg/kg/4 semaines IV ou 162 mg/semaine SC. La prescription était combinée à un immunosuppresseur chez 38,8% des patients (n=52) ou isolée chez 62,2% d’entre eux (n=82).
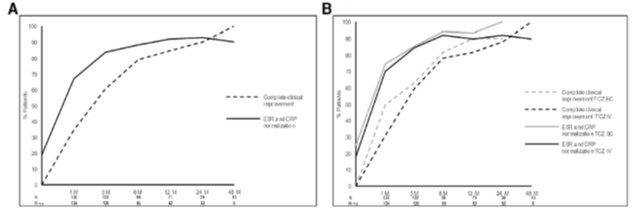
A un mois du début du TCZ, 93,3% (n=125) étaient considérés répondeurs, avec un taux de CRP médian passant de 17 à 1,1 mg/L (p<0,0001), une vitesse de sédimentation médiane passant de 33 à 6 mm à la première heure (p<0,0001). Les courbes A et B montrent le pourcentage de réponse dans la série entière (A) et selon la modalité d’administration du TCZ (B). La dose médiane de corticoïdes était diminuée de 15 à 13,75 mg/jour (p<0,0001). Au cours du suivi, une rémission persistante était constatée chez 69% des patients soit 27 des 39 suivis au moins 2 ans. La stratification sur la durée de la maladie avant traitement ne mettait pas en évidence de différence d'efficacité. Sept patients ont présenté une rechute après une rémission sous TCZ.
Concernant les effets indésirables, la durée médiane de suivi était de 12 mois. Trente-deux patients (23,9%) ont développé un effet indésirable, les plus fréquents étant les infections et les anomalies hématologiques. Des infections sévères étaient rapportées chez 16 patients. En comparant les patients avec et sans infection sévère, il n'existait pas de différences significatives d’âge ou de durée de la maladie. Les patients avec des infections sévères avaient une dose de corticoïdes plus importante (29,1 vs. 15 mg, p=0,01). Il n'existait pas d'association significative entre la survenue d'infections graves et la prescription concomitante d'immunosuppresseur ou la durée de prescription de TCZ.
Cinq patients sont décédés au cours du suivi, d'un AVC (n=2), de cancer pulmonaire (n=1), d’ulcère gastroduodénal (n=1) et de cause inconnue (n=1).
DISCUSSION
Cette étude présente une large série de patients atteints d’ACG traités par TCZ dans des conditions d'utilisation de la vie courante. Tous les patients inclus étaient traités par TCZ pour une maladie réfractaire ou des effets indésirables des traitements.
Ces résultats montrent une efficacité rapide et maintenue du TCZ dans l’ACG réfractaire, y compris dans le cadre de corticoïdes et immunosuppresseurs associés et fait du TCZ le traitement de choix en cas d'échec des corticoïdes ou d'effets secondaires mal tolérés.
Les effets indésirables notamment infectieux étaient plus fréquents que dans l'étude GiACTA et plus fréquents comparés aux études pivotales dans la polyarthrite rhumatoïde. Cette fréquence est probablement expliquée par les fortes doses de corticoïdes comparativement à GIACTA et par un âge médian plus élevé que les patients atteints de polyarthrite rhumatoïde. Les complications infectieuses n'étaient pas décrites précisément dans l'étude, et leur évolution n'était pas précisée.
Une limite importante à cette étude est le faible nombre de rechutes sous TCZ. Celles-ci étaient définies par l'augmentation du syndrome inflammatoire biologique alors qu'un effet induit du TCZ est la négativité de la CRP même en cas de rechute. Chez les patients traités par TCZ, ce sont donc les signes cliniques et/ou l'imagerie fonctionnelle qui devraient être utilisés pour le diagnostic de rechute.
Cette étude montre donc la possibilité de l'utilisation de TCZ en pratique clinique au prix d'effets secondaires fréquents, concernant un quart de la population, dont la moitié d’infections sévères, et non négligeables dans cette population âgée avec des comorbidités.
Références :
Frank Buttgereit, Eric L Matteson, Christian Dejaco, Bhaskar Dasgupta, Prevention of glucocorticoid morbidity in giant cell arteritis, Rheumatology, Volume 57, Issue suppl_2, 1 February 2018, Pages ii11–ii21, https://doi.org/10.1093/rheumatology/kex459
Loricera, J., Blanco, R., Hernández, J. L., Castañeda, S., Mera, A., Pérez-Pampín, E., et al. (2015). Tocilizumab in giant cell arteritis: Multicenter open-label study of 22 patients. Semin. Arthritis Rheum. 44, 717–23. doi:10.1016/j.semarthrit.2014.12.005.
Samson, M., Devilliers, H., Ly, K. H., Maurier, F., Bienvenu, B., Terrier, B., et al. (2018). Tocilizumab as an add-on therapy to glucocorticoids during the first 3 months of treatment of Giant cell arteritis: A prospective study. Eur. J. Intern. Med. 57, 96–104. doi:10.1016/j.ejim.2018.06.008.
Stone, J. H., Tuckwell, K., Dimonaco, S., Klearman, M., Aringer, M., Blockmans, D., et al. (2017). Trial of Tocilizumab in Giant-Cell Arteritis. N. Engl. J. Med. 377, 317–328. doi:10.1056/NEJMoa1613849.
Unizony, S., Arias-Urdaneta, L., Miloslavsky, E., Arvikar, S., Khosroshahi, A., Keroack, B., et al. (2012). Tocilizumab for the treatment of large-vessel vasculitis (giant cell arteritis, Takayasu arteritis) and polymyalgia rheumatica. Arthritis Care Res. (Hoboken). 64, 1720–9. doi:10.1002/acr.21750.
Villiger, P. M., Adler, S., Kuchen, S., Wermelinger, F., Dan, D., Fiege, V., et al. (2016). Tocilizumab for induction and maintenance of remission in giant cell arteritis: a phase 2, randomised, double-blind, placebo-controlled trial. Lancet 387, 1921–1927. doi:10.1016/S0140-6736(16)00560-2.
