Evaluation de l’anticoagulation dans la prise en charge d’une embolie pulmonaire sous-segmentaire symptomatique.
La prise en charge des patients diagnostiqués avec une embolie pulmonaire (EP) sous-segmentaire symptomatique est discutée.
L’amélioration des techniques d’acquisition tomodensitométriques a été associée à une augmentation des diagnostics d’EP sous-segmentaires dans la pratique clinique (1,2) ; cependant, des anomalies de petite taille pouvant évoquer une EP mono-segmentaire pourraient être de faux-positifs (3,4).
Certaines recommandations (CHEST 2016, ESC 2019) préconisent ainsi dans ce contexte la réalisation d’un écho-Doppler veineux des membres inférieurs afin de moduler la prise en charge thérapeutique. En cas de thrombose veineuse profonde proximale (TVP), une anticoagulation est recommandée ; tandis qu’en l’absence de TVP, il est suggéré soit une surveillance clinique en cas de faible risque de récidive d’événement thromboembolique veineux (ETEV), soit une anticoagulation en cas de risque élevé de récidive d’ETEV.
Une récente revue de la littérature Cochrane a cependant rappelé l’absence de preuve validant cette stratégie (5).
L’objectif de cette étude était de comparer les taux de récidive d’EP symptomatique, de saignement majeur, de décès, au cours du traitement anticoagulant chez des patients d’une EP symptomatique sous-segmentaire, ou segmentaire, ou « centrale ».
METHODES
Le recueil des données a été réalisé à partir du registre observationnel prospectif multicentrique international RIETE. Au sein de ce registre, des patients avec une TVP et/ou EP aiguë documentées (respectivement soit par écho-Doppler ou phlébographie, soit par angiographie pulmonaire ou scintigraphie de ventilation / perfusion ou angioscanner thoracique) y sont consécutivement inclus depuis mars 2001.
Ont été inclus consécutivement dans l’étude les patients avec une EP aiguë symptomatique confirmée par angioscanner thoracique.
La localisation de l’embolie pulmonaire étant une variable documentée dans RIETE depuis 2009, tous les patients du registre RIETE avec un premier épisode d’EP aiguë symptomatique diagnostiquée entre janvier 2009 et janvier 2019 ont été pris en compte pour cette étude.
Les critères d’exclusion étaient un antécédent personnel de maladie thromboembolique veineuse et le caractère asymptomatique de l’EP.
Le critère de jugement principal était la récidive aiguë d’EP symptomatique au cours du traitement par anticoagulant des patients porteurs d’une EP sous-segmentaire, segmentaire, ou « centrale ».
Chaque suspicion clinique de récidive d’EP était investiguée par la réalisation d’un angioscanner (ou d’une angiographie pulmonaire).
Les critères de jugement secondaires étaient l’embolie pulmonaire fatale, la survenue d’un saignement majeur, et la mortalité toutes-causes confondues.
La détermination de la localisation des EP était fonction du niveau de l’atteinte radiologique : soit sous-segmentaire, soit segmentaire (avec ou sans atteinte des artères segmentaires), soit « centrale » (artères lobaires ou artères pulmonaires, avec ou sans atteinte des artères segmentaires/sous-segmentaires).
Tous les participants étaient suivis pour une durée minimale de 3 mois après leur retour à domicile. En cas de consentement du participant, le suivi pouvait être prolongé au long cours.
Une « embolie pulmonaire fatale » était définie par la survenue d’un décès dans les 10 jours suivant son diagnostic sans autre cause pouvant expliquer le décès.
Une hémorragie était qualifiée de « saignement majeur » si elle nécessitait la transfusion d’au moins deux culots de globules rouges ; si elle était rétro péritonéale, vertébrale ou intracrânienne, ou fatale.
Un « saignement fatal » était défini par la survenue d’un décès dans les 10 jours consécutifs à un saignement majeur, sans autre cause pouvant expliquer le décès.
La terminologie « cancer actif » comprenait les cancers diagnostiqués dans les 3 mois précédant le diagnostic initial d’embolie pulmonaire, les cancers métastatiques, les cancers actifs.
RESULTATS
Caractéristiques cliniques
Parmi les 15963 patients ayant eu un premier épisode d’EP symptomatique : 834 (5%) avaient une EP sous-segmentaire, 3797 (24%) avaient une EP segmentaire, et 11 332 (71%) avaient une « EP centrale ». Leur âge moyen était respectivement de 64, 65 et 67 ans ; 48% des patients étaient des hommes.
Les patients porteurs d’une EP sous-segmentaire ou segmentaire avaient plus tendance à avoir un cancer actif ou une chirurgie récente que les patients porteurs d’une « EP centrale », alors qu’ils avaient moins tendance à avoir eu une immobilisation récente (Tableau 1);
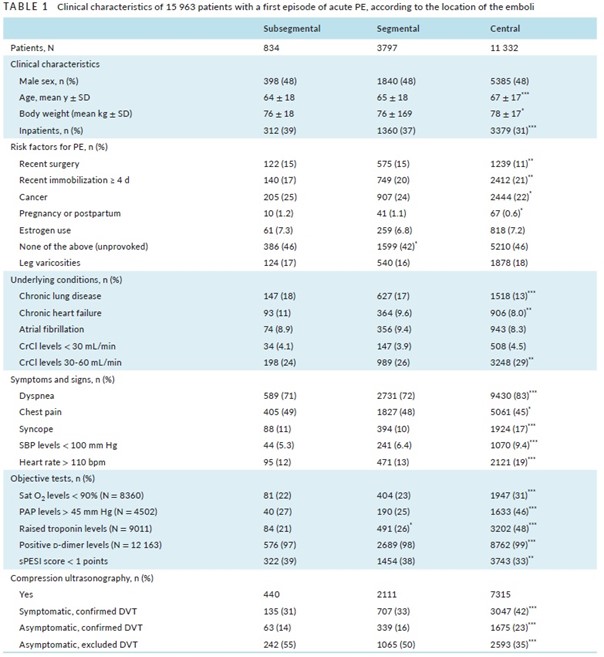
La présence de signes cliniques tels qu’une dyspnée, une syncope, une hypotension, une tachycardie, une hypoxémie, ainsi que la perturbation des marqueurs de retentissement cardiaque (biologiques ou échocardiographiques) était plus fréquente chez les patients ayant une « EPcentrale ».
La présence d’une TVP des membres inférieurs était plus faible chez les patients ayant une EP sous-segmentaire (45%) ou segmentaire (50%), que chez les patients ayant une « EP centrale » (65%).
Stratégies thérapeutiques
La grande majorité des patients a bénéficié d’un traitement anticoagulant ; 15 patients (0.09%) n’ont pas été anticoagulés et n’ont pas été inclus dans l’analyse. Plus de 85% ont été initialement traités par HBPM (dont la posologie était la même quelle que soit la localisation de l’EP), puis la majorité ont bénéficié d’un relais AVK ; l’utilisation des AOD était marginale (<15%) car leur utilisation n’était initialement pas validée.
Les durées médianes d’anticoagulation étaient similaires quelle que soit la localisation de l’EP ; sous-segmentaire, segmentaire ou « centrale » (respectivement 179, 185 et 204 jours).
Le recours à la thrombolyse ou la pose d’un filtre cave était plus important chez les patients ayant une « EP centrale » que chez les patients ayant une EP segmentaire ou sous-segmentaire.
Résultats
Au cours du traitement anticoagulant, 183 patients (1.1%) ont présenté des récidives symptomatiques d’EP ; 131 patients (0.8%) ont eu une récidive de TVP ; 543 patients (3.4%) ont eu des saignements majeurs ; 1718 patients sont morts (10.8%) (114 morts suite à l’EP initiale, 21 morts suite à la récidive d’EP, 83 ont présenté un saignement fatal).
Les patients porteurs d’une EP sous-segmentaire avaient un taux de récidive significativement supérieur à celui des patients porteurs d’une EP segmentaire (HR 2.13; IC 95% 1.16-3.85) ou d’une « EP centrale » (HR, 1.89; 95% CI, 1.12-3.13) (Tableau 3). L’analyse multivariée confirme cette donnée : les patients avec une EP sous-segmentaire avaient un risque de récidive d’EP accru par rapport aux patients ayant une EP plus proximale (HR ajusté 1.75 ; IC 95% 1.02-3.03).
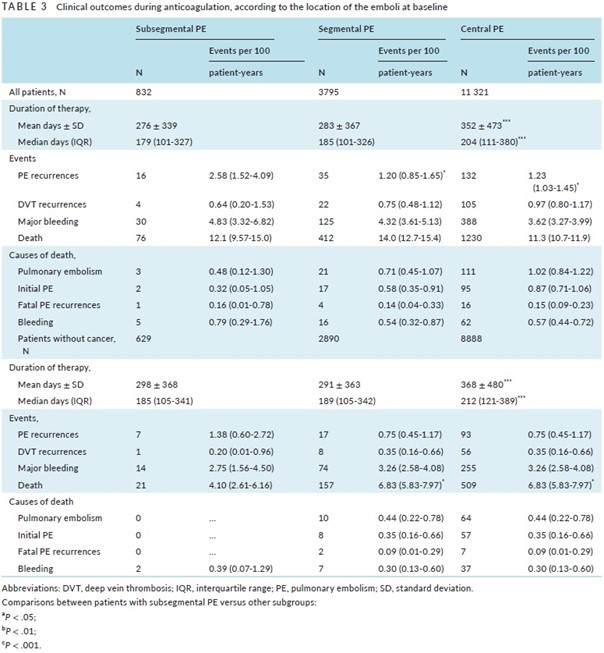
Quarante-sept pour cent des récidives d’EP chez les patients ayant eu une EP sous-segmentaire sont survenues au cours des 30 premiers jours de traitement, alors que l’on n’observait des récidives d’EP que chez 23% et 33% des patients ayant eu respectivement une EP segmentaire ou une EP centrale (Figure 1).
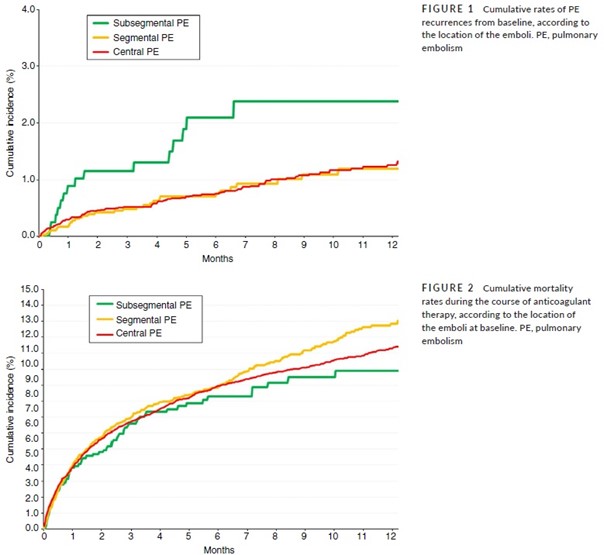
Ce taux accru de récidives chez les patients ayant eu une EP sous-segmentaire persistait après l’élimination de ceux porteurs d’un cancer actif (Tableau 3).
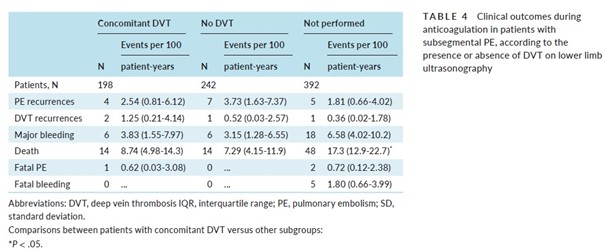
Parmi les patients ayant eu une EP sous-segmentaire, le taux de récidive d’EP était similaire entre ceux ayant eu une TVP associée, ceux qui n’avaient pas de TVP, et ceux qui n’avaient pas eu d’écho-Doppler (Tableau 4)
Les taux de saignements majeurs, de décès toutes-causes confondues, de récidive de TVP ou d’EP fatale étaient similaires dans les trois sous-groupes d’EP (sous-segmentaire, segmentaire, centrale).
DISCUSSION
Au sein de cette étude de « vie réelle », seulement une EP aiguë sur 20 avait une localisation strictement sous-segmentaire (834/15963 ; 5,2%).
La grande majorité des patients porteurs d’EP sous-segmentaire a bénéficié d’une anticoagulation dont la posologie et la durée étaient similaires à celles menées chez les patients porteurs d’une EP plus proximale.
Paradoxalement, le taux de récidive d’EP symptomatiques a été plus élevé chez les patients ayant eu une EP sous-segmentaire que chez ceux ayant eu une EP plus proximale, et ce notamment lors des 30 premiers jours d’anticoagulation.
Cela pourrait s’expliquer par une moins bonne gestion des INR, une mauvaise appréciation des récidives d’EP, ou une confusion liée à la présence de séquelles résiduelles.
Le taux de mortalité des patients ayant eu une EP sous-segmentaire était similaire à celui des patients ayant eu une EP plus proximale.
Concernant ce résultat, les autres données de la littérature sont contradictoires : certaines études retrouvent un taux de mortalité similaire à 3 mois que l’EP soit centrale ou non (6,7), alors qu’une autre étude retrouvait que le caractère central d’une EP était associé à un risque accru de décès et d’aggravation clinique (8).
Ces données recueillies chez les patients ayant eu une EP sous-segmentaire n’étaient conditionnées ni par la présence ou non d’un cancer, ni par la présence ou non d’une TVP des membres inférieurs.
De nombreuses remarques peuvent être émises.
- D’abord, il existe un risque de surdiagnostic d’embolies pulmonaires sous-segmentaires, et ce d’autant plus qu’il n’y a pas eu d’adjudication centralisée des angioscanners réalisés. De plus, la classification topographique sous-segmentaire des embolies pulmonaires pourrait être erronée du fait de l’absence de consensus diagnostique.
- Ensuite, il peut exister un biais de sélection lié au fait que les patients porteurs d’une embolie pulmonaire sous-segmentaire non-traitée ne sont vraisemblablement pas inclus dans le registre RIETE.
- Par ailleurs, il n’a pas été possible de caractériser plus précisément les récidives d’embolie pulmonaire, notamment sur le plan topographique.
- La taille de l’échantillon des patients non-traités était insuffisante pour établir une conclusion.
- Le traitement actuel des EP repose sur les AOD, dont la gestion plus simple par rapport aux AVK pourrait avoir un impact favorable quant à la survenue des récidives thrombotiques ou des complications hémorragiques.
Cette étude rappelle qu’une EP sous-segmentaire n’est pas juste une « petite embolie pulmonaire », et que le risque de récidive d’EP n’est pas favorisé par une localisation anatomique plus proximale. La question de l’anticoagulation dans l’EP sous-segmentaire sans TVP associée est toujours d’actualité, et la sécurité d’une abstention thérapeutique dans cette situation est actuellement étudiée.
Références
1. Goy J and al. Sub-segmental pulmonary embolism in three academic teaching hospitals: a review of management and outcomes. J Thromb Haemost. 2015
2. Auer RC and al. Use of helical CT is associated with an increased incidence of postoperative pulmonary emboli in cancer patients with no change in the number of fatal pulmonary emboli. J Am Coll Surg JAm Coll Surg. 2009
3. Costantino G and al. Interobserver agreement in the interpretation of computed tomography in acute pulmonary embolism. Am J Emerg Med. 2009
4. Hutchinson BD and al. Overdiagnosis of pulmonary embolism by pulmonary CT angiography. Am J Roentgenol. 2015
5. Yoo HHB and al. Anticoagulant treatment for subsegmental pulmonary embolism (Review). Cochrane Database Syst Rev. 2016
6. Gouin B and al. Clinical prognosis of non-massive central and non-central pulmonary embolism: a registry-based cohort study. Chest. 2017
7. den Exter PL and al. Risk profile and clinical outcome of symptomatic subsegmental acute pulmonary embolism. Blood. 2013
8. Vedovati MC and al. Multidetector CT scan for acute pulmonary embolism: embolic burden and clinical outcome. Chest.2012
