Abréviations et acronymes : MCVA maladie cardiovasculaire athéroscléreuse ; SCC score calcique coronaire ; CoroTDM coronarographie par tomodensitométrie ; LDL lipoprotéine de basse densité ; Lp(a), lipoprotéine(a) ; OxPL phospholipides oxydés ; [PFA plaque à faible atténuation : RCV risque cardio vasculaire].
Les guidelines actuelles recommandent de mesurer la Lp(a) pour identifier les patients à risque élevé de maladie cardiovasculaire athéroscléreuse (MCVA).
Particule complexe, la lipoprotéine(a) (Lp(a)) est une lipoprotéine de basse densité à laquelle est liée de manière covalente l’apolipoprotéine(a), transporteur de phospholipides oxydés (OxPL) pro-inflammatoires (Annexe). Les mécanismes athérogènes de la Lp(a), associeraient l’accumulation du composant lipoprotéine de basse densité (LDL) dans la plaque athéroscléreuse, les effets prothrombotiques dus à l’interaction entre la terminaison de l’apolipoprotéine(a) et l’activation du plasminogène, ainsi que l’induction d’une réponse pro-inflammatoire médiée par la quantité d’OxPL. Les effets prothrombotiques et pro-inflammatoires de la Lp(a) favoriseraient la déstabilisation de la plaque conduisant à une rupture de plaque et aux événements athérothrombotiques.
La Lp(a) est un facteur reconnu, prévalent et indépendant, de risque cardiovasculaire (RCV). Des essais cliniques récents ont confirmé qu’elle est un marqueur puissant du RCV résiduel, associée à un risque accru d’infarctus du myocarde (IDM), et ce même chez les patients recevant un traitement hypolipémiant intensif. Des études antérieures ont montré chez des patients coronariens une association entre des taux sériques élevés de Lp(a), une augmentation des volumes de plaque et la présence de caractéristiques défavorables de la plaque. Cependant, les données sur le(s) mécanisme(s) sous-jacent(s) qui associerai(en)t la Lp(a) l’augmentation du risque de MCVA à la modification du volume et de la structure de la plaque, font défaut : le lien reste incertain et sujet à discussion.
La CoroTDM permet d’évaluer quantitativement, avec une bonne reproductibilité, les types de plaque athéroscléreuse et la progression de la maladie d’une part, les changements de forme de la plaque d’autre part. Des études récentes ont montré une forte association entre les événements cliniques et la structure de la plaque déterminée par TDM : surtout la charge de la plaque à faible atténuation (PFA) (définie par une densité d’atténuation < 30 HU*), marqueur du noyau nécrotique et puissant prédicteur de la survenue d’un IDM, qui surpasse les scores de risque clinique, le degré de la sténose luminale et le SCC.
Cette étude de cohorte monocentrique, souhaite répondre à une question principale : des concentrations sériques élevées de Lp(a) sont-elles fortement associées à une progression des caractéristiques défavorables de la plaque athéroscléreuse, chez des patients atteints d’une maladie coronarienne avancée stable, traités préventivement suivant les recommandations en cours ?
*HU unité Hounsfield. Mesure quantitative de la radio densité utilisée dans l’évaluation des scanners : de – 1000 HU pour l’air à + 1000 HU pour l’os (0 HU eau).
METHODES
Les patients ont été recrutés prospectivement entre mars 2015 et mars 2017, au sein de l’essai DIAMOND randomisé, en double aveugle, contre placebo (Dual Antiplatelet Therapy to Inhibit Coronary Atherosclerosis and Myocardial Injury in Patients With Necrotic High-Risk Coronary Plaque Disease).
Ont été inclus des patients âgés de plus de 40 ans présentant des signes de maladie coronarienne cliniquement stable, multivasculaire, prouvée par angiographie et définie par l’atteinte d’au moins 2 vaisseaux majeurs soit par une combinaison de sténoses luminales > 50% soit par une revascularisation antérieure (intervention coronarienne percutanée ou pontage aortocoronarien). Ont été exclus les patients ayant bénéficié d’une revascularisation coronarienne au cours des 3 mois précédents ou ayant présenté un syndrome coronarien aigu au cours des 12 mois précédents.
Des échantillons de sérum et de plasma ont été prélevés à l’inclusion et conservés à moins 80°C jusqu’à une utilisation ultérieure. Le LDL-C a été calculé à l’aide de l’équation de Friedewald. La Lp(a) a été mesurée ultérieurement à partir d’échantillons de sérum congelés, à l’aide d’un test immunologique indépendant KIV2.
Les images initiales de CoroTDM ont été acquisespar tomographie hybride à l’aide d’un protocole d’étude standardisé. Avant le début de l’examen, les patients ayant une fréquence cardiaque au repos > 65 battements / mn ont reçu, sauf contre-indication, un bétabloquant par voie orale (50 à 100 mg de métoprolol). Le SCC a été calculé à partir d’images de TDM sans contraste. Après un intervalle de 12 mois, la CoroTDM et le SCC ont été répétés dans les mêmes conditions.
1. Le SCC a été quantifié par patient et par segment, sur une TDM sans contraste interprétée par un observateur expérimenté utilisant un logiciel dédié. Il a été calculé (unités d’Agatston) à l’aide de la méthode d’Agatston**. Les stents coronaires ont été exclus de l’analyse n’incluant que le score calcique proximal ou distal aux extrémités de l’endoprothèse.
2. Sur la CoroTDM, l’analyse sectorielle a été effectuée selon la classification modifiée à 17 segments de l’American Heart Association. Les segments et les vaisseaux ont été identifiés par des points de repère tels que bifurcations et affluents : ceux porteurs de stents ont été exclus. Un nombre égal de segments et de vaisseaux ont été évalués à l’inclusion et 12 mois
après. La gravité de la sténose luminale a été estimée visuellement et un score d’atteinte segmentaire a été calculé, égal au nombre total de segments artériels coronaires présentant des plaques, sans tenir compte du degré de sténose luminale : minimum 0, maximum 16.
3. Analyse de plaque TDM.Les mesures (dont la reproductibilité a été auparavant prouvée excellente) ont été effectuées à l’aide d’un logiciel semi-automatisé précédemment validé, par un observateur formé ignorant tout du statut clinique du patient. L’extraction s’est faite de manière semi-automatisée pour chaque artère principale et tout affluent de diamètre > 2
4. Analyse statistique. Les données dont présentées sous forme de moyenne ± et de DS pour les variables normalement distribuées, de médiane avec intervalle (IQR) pour les variables non normalement distribuées et de nombre (%) pour les variables catégorielles. En fonction de la valeur seuil utilisée pour les essais de prévention secondaire, une Lp(a) élevée a était définie par une concentration sérique ≥ 70 mg/dL et deux groupes constitués. Les comparaisons entre les groupes au départ ont été évaluées à l’aide d’un test t de Student pour les données normalement distribuées, mann-Whitney U pour les données non distribuées normalement et du test du χ2 pour les données catégorielles.
L’étude de la variation en % du volume de plaque au début et à 12 mois, a été faite grâce à une analyse univariable et multivariable tenant compte de l’indice de masse corporelle, du score d’implication sectorielle (marqueur pronostique de la charge globale de plaque) et du score ASSIGN*** calibré en fonction de la population écossaise.
** Score d’Agatston : outil semi-automatisé permettant de calculer un score basé sur l’étendue de la calcification artérielle coronaire détectée par TDM sans contraste. Permet une stratification précoce du risque : les patients ayant un score d’Agatston élevé (>160) ont un risque accru d’événement cardiaque indésirable majeur. Ne permet pas d’évaluer les plaques molles non calcifiées, mais bonne corrélation avec la CoroTDM de contraste.
*** score ASSIGN incluant la privation sociale/défavorisation et les antécédents familiaux polyarthrite rhumatoïde aux cotés des facteurs de risque traditionnels (âge, sexe, tabagisme, pression artérielle, CHOL total et HDL-C, diabète. Dérivé des résultats cardiovasculaires de la Scottish Hearth Health Extended Cohort (SHHEC), il a été testé par rapport au score RCV de Framingham dans la même base de données.
RESULTATS
Cette cohorte était composée de191 patientsd’âge moyen 65,3 ± 8,3 ans majoritairement des hommes 153 (79,7 %), qui présentaient tous une maladie coronarienne athéroscléreuse multivasculaire stable avancée (définie par des antécédents de syndrome coronarien aigu (SCA) antérieur (71,5%) d’intervention coronarienne percutanée (77,9%) de pontage aortocoronarien (17,9%)) : 180 patients (94,7 %) recevaient des statines et 191 (100 %) un traitement antiplaquettaire. Les valeurs médianes de Lp(a) sérique étaient de 100 mg/dL (intervalle : 82 à 115) dans le groupe à Lp(a) élevée et de 10 mg/dL (intervalle : 5 à 24) dans le groupe à Lp(a) basse. Dans l’ensemble de la cohorte, le volume initial de la plaque totale était de 1 378 mm3 (intervalle 1 048 à 1 994 mm3) ; de 1 282 mm3 (intervalle 959 à 1 692 mm3) pour la plaque non calcifiée; de 95 mm3 (intervalle 37 à 224 mm3) pour la plaque calcifiée; et de 87 mm3 pourla PFA (intervalle 48 à 168 mm3). La CoroTDM de suivi a été effectuée après 12 mois, pour 160 personnes (83,8 %).
Deux groupes de patients ont été constitués.Le premier de 43 patients à Lp(a) sérique élevée (≥70 mg / dL), le second de 148 patientsà Lp(a) sérique basse (<70 mg / dL). Entre les deux groupes, il n’y avait aucune différence dans l’indice de masse corporelle, le tabagisme, le diabète sucré, le LDL-C et les concentrations sériques de créatinine.
Les patients avec une Lp(a) élevée avaient un HDL-C plus élevé (1,27 ± 0,39 mmol / L versus 1,11 ± 0,28 mmol / L ; P = 0,003), et une PA systolique plus basse (141 ± 18 mm Hg versus 148 ± 20 mm Hg ; P = 0,035). Le score ASSIGN était plus élevé dans le groupe à Lp(a) basse (27,7 % ± 16,0 % contre 20,6 % ± 10,1 % ; P = 0,006).
Il n’y avait pas de différence initiale entre les groupes à taux élevé et bas de Lp(a), en termes de volumes de plaque totale, calcifiée, non calcifiée et de PFA. La charge de la plaque était similaire entre les deux groupes. Le SCC était comparable entre les 2 groupes : 378 dans le groupe à Lp(a) élevée vs 371.
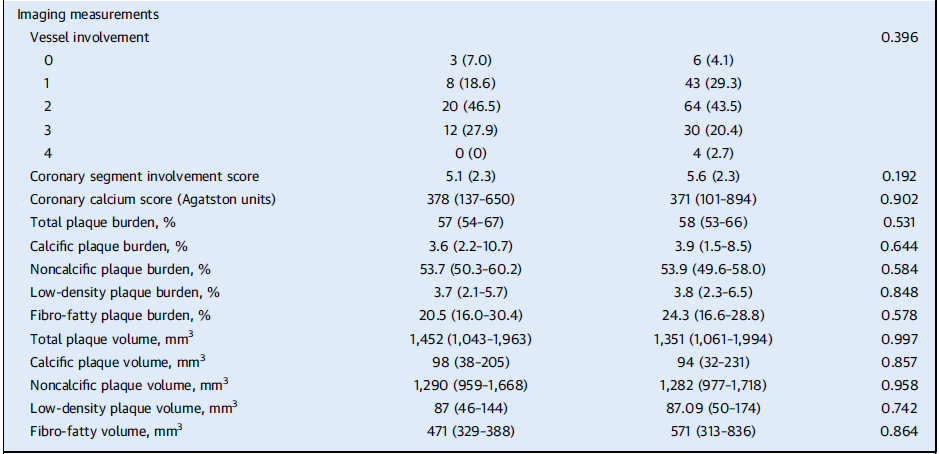
Taux élevés de Lp(a) et progression accélérée de la plaque vulnérable.
Au départ, il n’y avait aucune différence dans la gravité de la maladie coronarienne ou la charge de plaque.Parmi les 160 patients (84%) ayant bénéficié à 12 moisd’une nouvelle CoroTDM, une augmentation moyenne globale des volumes de plaques coronaires a été rapportée [de 83,0 ± 293,4 mm en volume total de plaque, 4,4 ± 76,2mm en volume de plaque calcifiée, 78,6 ± 274,0 mm en volume de plaque non calcifiée, et 4,6 ± 56,7 mm dans les volumes de PFA].
Dans le groupe à Lp(a) élevée, il a été noté une progression accélérée plus importante de la PFA (26,2 ± 88,4 mm3 vs −0,7 ± 50,1 mm3 ; P = 0,020) ;ainsi qu’une augmentation plus importante des volumes de plaque fibro-graisseuse (55,0 ± 242,8 mm3 vs −25,0 ± 157,4 mm3 ; P = 0,020). Il n’y avait pas de différence dans la variation du volume total de plaque ou de variation dans les volumes de plaque calcifiée et non calcifiée entre les 2 groupes.
|
Modification des volumes de plaque sur la CoroTDM à 12 mois chez les patients à Lp(a) élevée et basse. |
|||
|
|
Lp(a) ≥70 mg/dL (n = 36) |
Lp (a) <70 mg/dL (n = 125) |
Valeur p |
|
Changement de volume |
|||
|
de plaque(variation totale) |
128,2 ± 330,6 |
88,5 ± 312,2 |
0,508 |
|
de plaque calcifiée |
19,7 ± 69,7 |
1,0 ± 85,7 |
0,231 |
|
de plaque non calcifiée |
108,5 ± 319,6 |
87,5 ± 288,6 |
0,708 |
|
de plaque à faible atténuation |
26,2 ± 88,4 |
-0,7 ± 50,1 |
0,020 |
|
de plaque fibro-graisseuse |
55,0 ± 242,8 |
-25,0 ± 157,4 |
0,020 |
|
Les valeurs de p en gras < 0,05 montrent des différences statistiquement significatives |
|||
Augmentation de la Lp(a) et progression de la PFA.
Dans l’analyse de régression univariable, la Lp(a) était associée à une progression du volume de PFA (β = 11,6 % pour chaque augmentation de 50 mg/dL (IC à 95 % : 2,0 % à 21,2 % ; P = 0,018), mais pas à une progression des volumes de plaque totale, calcifiée et non calcifiée. L’analyse de régression linéaire multivariable a confirmé la relation entre la Lp(a) et la progression accélérée du volume de PFA (β = 10,5 % pour chaque augmentation de 50 mg/dL Lp(a), IC à 95 % : 0,7 %-20,3 %). Si le taux élevé de Lp(a) (≥70 mg/dL) était considéré comme variable catégorielle pour évaluer la relation avec la variation absolue du volume de la PFA, les résultats demeuraient inchangés.
|
Lp(a) élevée et variation absolue des volumes de plaque coronaire sur CoroTDM à 12 mois. |
|
|||||
|
|
Univariable |
Multivariable. |
|
|||
|
Bêta (IC à 95 %) |
Valeur P |
Bêta (IC à 95 %) |
Valeur P |
|||
|
Changement de volume |
||||||
|
de plaque (variation totale) |
50,1 (−65,4 à 165,6) |
0.393 |
−23,2 (−140,4 à 94,1) |
0,697 |
|
|
|
de plaque calcifiée |
19,1 (−11,9 à 50,1) |
0.226 |
−12,9 (−44,6 à 18,9) |
0,425 |
|
|
|
de plaque non calcifiée |
31,0 (−76,8 à 138,8) |
0.571 |
−10,3 (−120,2 à 99,6) |
0,853 |
|
|
|
de plaque à faible atténuation |
27,9 (5,3 à 50,5) |
0.016 |
25,4 (2,5 à 48,2) |
0,030 |
|
|
|
de plaque fibro-graisseuse |
84,3 (17,6 à 150,9) |
0.014 |
73,8 (6,3 à 141,3) |
0,032 |
|
|
|
Les valeurs sont des ß avec un IC de 95% pour la variation absolue du volume de plaque (mm3) chez les patients présentant une Lp(a) sérique ≥70 mg/dL. L’analyse de régression linéaire multivariable est ajustée en fonction de l’indice de masse corporelle, du score ASSIGN et du score d’implication sectorielle. Les valeurs P en gras <0,05 montrent des différences statistiquement significatives. |
|
|||||
Les résultats étaient similaires en ce qui concerne la progression de la plaque fibro-graisseuse.
|
Augmentation de la Lp(a) et variation des volumes de plaque coronaire sur CoroTDM à 12 mois. |
|
||||
|
|
Univariable |
Multivariable. |
|
||
|
Bêta (IC à 95 %) |
Valeur P |
Bêta (IC à 95 %) |
Valeur P |
||
|
Changement de volume |
|||||
|
de plaque (variation totale) |
0,3 (−3,9 à 4,5) |
0,887 |
0,81 (−5,0 à 3,4) |
0,701 |
|
|
de plaque calcifiée |
−9,6 (−40,6 à 21,4) |
0,542 |
−12,75 (−44,5 à 19,0) |
0,428 |
|
|
de plaque non calcifiée |
0,0 (−4,2 à 4,3) |
0,988 |
−1,0 (−5,2 à 3,2) |
0,631 |
|
|
de plaque à faible atténuation |
11,6 (2,0 à 21,2) |
0,018 |
10,5 (0,7 à 20,3) |
0,037 |
|
|
de plaque fibro-graisseuse |
7,0 (0,9 à 13,2) |
0,025 |
6,2 (−0,1 à 12,4) |
0,053 |
|
|
Les valeurs sont des ß avec un IC de 95 % pour la variation en % du volume de plaque, normalisés pour chaque augmentation de 50 mg/dL de Lp(a) sériques. L’analyse de régression linéaire multivariable est ajustée en fonction de l’indice de masse corporelle, du score ASSIGN et du score d’implication sectorielle. Les valeurs P en gras <0,05 montrent des différences statistiquement significatives. |
|
||||
DISCUSSION
Les auteurs soulignent qu’au cours de cette étude de cohorte monocentrique (Centre Cardiaque d’Edimbourg (Royaume-Uni)) menée chez des patients atteints de maladie athéroscléreuse coronarienne multivasculaire avancée,la CoroTDM et les techniques d’analyse quantitative semi-automatisées ont permis l’étude de la relation entre les concentrations sériques de Lp(a) et la progression du volume et du phénotype de la plaque coronaire mais également une évaluation non invasive de différents types de plaque et de leur progression au fil du temps. Technique à la reproductibilité avérée, utilisée pour la première fois au début et en fin d’étude.
Par ailleurs cette étudea montré que :
1)
Des taux sériques élevés de Lp(a) (≥70 mg/dL) étaient associés après 12 mois, à une progression accélérée du volume et du phénotype de la plaque coronaire, plus spécifiquement de la PFA.
2)
La charge de la PFA est un marqueur quantitatif du noyau nécrotique. Elle fournit des informations pronostiques sur les évènements cardiovasculaires futurs, ce qui lui confère un rôle prédictif plus puissant d’IDM mortel ou non : en accord avec les résultats des essais SCOT-HEART et ICONIC.
3)
La Lp(a) était associée à une progression accélérée de la PFA chez des patients présentant une maladie coronarienne établie de gravité comparable au départ. Donc la Lp(a) entraînerait un risque de MCVA en favorisant la progression des phénotypes de plaque vulnérable.
4)
Les données recueillies fournissent un argument supplémentaire pour considérer la Lp(a) en tant que nouveau marqueur de RCV résiduel et réaffirment son potentiel en tant que cible thérapeutique dans l’athérosclérose coronarienne, en particulier dans la population étudiée ici.
Les auteurs s’interrogent sur les éventuels éclaircissements apportés par ces résultats quant au rôle physiopathologique de la Lp(a) dans la maladie coronarienne. L’absence de différences entre les deux groupes dans la progression du volume total de la plaque ou des sous-types de plaque plus stables pourrait signifier que l’accumulation pure de particules de Lp(a) dans la plaque d’athérosclérose ne semble pas être le mécanisme dominant. Au lieu de cela, il a été observé que les patients ayant une Lp(a) élevée présentaient une progression accélérée du phénotype de PFA marqueur du noyau nécrotique. L’augmentation des niveaux de Lp(a) circulante peut donc entraîner une progression de la PFA, principalement via les OxPL et leurs effets pro-inflammatoires. L’absence de différence initiale dans les charges de plaque coronaire entre les deux groupes constituerait un signal fort permettant d’évaluer l’effet de la Lp(a) sur la progression de la plaque indépendamment de la charge de plaque de base, déterminant majeur de la progression de la maladie. Les auteurs précisent que ceci est en contradiction avec plusieurs études antérieures d’échographie intravasculaire, qui ont montré des différences de base dans la charge de plaque avec les concentrations de Lp(a), dans des cohortes de patients à faible risque dans un contexte de prévention primaire.
Et les auteurs de définir un possible biais de sélection dans leur cohorte qui a recruté des patients ayant tous une charge élevée de plaque et une charge élevée de plaque indésirable, quelle que soit leur concentration de Lp(a).
Limites de l’étude
·
L’étude comprend l’un des plus grands nombres de patients consécutifs recrutés prospectivement dans une cohorte pour subir une nouvelle CoroTDM pour l’évaluation de la progression de la plaque coronaire, mais elle est monocentrique composée d’une population masculine en grande partie caucasienne.
·
Les auteurs avaient précédemment prouvé la reproductibilité de l’évaluation de la plaque en CoroTDM. La répétition de la CoroTDM a été utilisée dans des essais randomisés plus petits tels que l’étude EVAPORATE. Mais l’effet de la LP(a) sur d’autres types de plaque ne peut être éliminé et il est nécessaire de confirmer ces résultats sur de plus grandes populations.
·
Le groupe de patients était très centré sur une pathologie coronarienne stable avancée en prévention secondaire, pour lequel l’abaissement de la Lp(a) est susceptible de prouver le bénéfice maximal (étude en cours de phase 3 HORIZON).
CONCLUSION
Malgré la présence de traitements préventifs conformes aux guidelines, chez des patients atteints d’une maladie coronarienne stable avancée, des concentrations sériques élevées de Lp(a) sont fortement associées à une progression accélérée des caractéristiques défavorables de la plaque athéroscléreuse coronaire, en particulier la plaque à faible atténuation marqueur du noyau nécrotique, prédicteur le plus puissant de l’infarctus du myocarde, surpassant les scores de RCV, le degré de la sténose luminale, le SCC et le poids de tous les autres sous-types de plaque .
Il s’agit là d’une explication mécanistique à l’association entre la Lp(a) et le risque résiduel élevé d’infarctus du myocarde, qui apporte un argument pour soutenir la thèse de la Lp(a) comme nouvelle cible thérapeutique dans l’athérosclérose. Des essais contrôlés randomisés sont nécessaires pour évaluer si la diminution du taux de Lp(a) sérique entraine une réduction à la fois de la progression de la plaque à faible densité et de la survenue d‘événements cardiovasculaires.
COMMENTAIRES
La Lp(a) connue depuis 1963, revient sur le devant de la scène cardiovasculaire tant son rôle dans l’estimation du risque de MCVA et du RCV résiduel se révèle important.
Cette étude est intéressante puisqu’elle fournit une explication mécanistique potentielle à propos de l’association entre une Lp(a) élevée et le RCV résiduel chez les patients déjà traités en prévention secondaire : association qui semble robuste et indépendante de la gravité initiale de la maladie, des facteurs de RCV, de la charge de la plaque. Les études de thérapeutiques ciblant la réduction de Lp(a) confirmeront-elles ce lien ?
En corollaire, l’étude confirme aussi que l’imagerie TDM répétée est fiable pour évaluer la progression du volume et du phénotype de la plaque coronaire quel que soit le RCV du patient. Mais le processus de caractérisation des plaques et sous-plaques est lent et mériterait d’être plus automatisé.
On peut, avec les auteurs, souhaiter que des études multicentriques, utilisant différents scanners et recrutant des populations plus importantes et plus diverses de patients coronariens à risques élevé et modéré, soient menées pour confirmer ces résultats.
Voire de les étendre à terme, à des populations plus générales de patients atteints de maladie artérielle athéroscléreuse.
Info : Les fiches de synthèse du consensus international 2021 de la NSFA sur la Lp(a) seront disponibles en ligne sur le site de la Sfmv.
Annexe
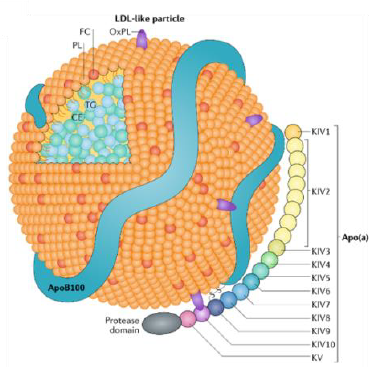
Structure de la Lp(a) contenant une particule d'Apo A et d'Apo B. Adapté de Boffa et al Nature 2019. In « Impact de la lipoprotéine(a) sur les maladies cardiovasculaires en fonction du sexe. » J. Guertin mémoire Maîtrise en sciences cliniques et biomédicales. Québec 2020.
