Réintroduction d’un traitement anticoagulant après saignement intra-cérébral sous anticoagulant : revue systématique et méta-analyse.
Les saignements majeurs sont la principale cause de décès compliquant un traitement (TRT) anticoagulant (AC) (0,3 à 4,5 % / an par hémorragie digestive, 0,3 à 0,7 % / an par hémorragie intra-crânienne (HIC)). La cause la plus fréquente de décès par hémorragie est l’HIC. De plus, les HIC sous traitement AC sont de moins bon pronostic que les HIC spontanées.
Pour les patients qui ont survécu à une HIC sous AC, après arrêt des AC, le risque thrombo-embolique est toujours présent et élevé (prothèses valvulaires mécaniques, FA). Une méta-analyse a montré que la reprise des AVK après hémorragie digestive réduisait les évènements thrombo-emboliques et la mortalité sans augmenter le risque de récidive hémorragique au plan digestif (Chai-Adisaksopha, Thromb Haemost, 2015).
Cette revue systématique avec méta-analyse se propose de réactualiser les connaissances sur la mortalité à long terme, le risque de récidive hémorragique et le risque de complication thrombo-embolique, après réintroduction du traitement AC chez les patients ayant survécu à une HIC sous AC.
|
METHODE
|
|
|
Question |
Evaluation du bénéfice et des risques en cas de réintroduction du traitement anticoagulant après une hémorragie cérébrale sous anticoagulant.
|
|
RS et MA |
Selon le protocole PRISMA
|
|
Eligibilité |
Critères d’inclusion : - RCT ou études de cohortes - Patients ≥ 18 ans sous AC au moment de l’HIC, survivants après la phase aigüe - Hémorragies intracrâniennes (HIC) non traumatiques à l’inclusion - Recueil des complications thromboemboliques (IC, IDM, MTEV) et des complications hémorragiques (récidive d’HIC) pendant le suivi - Recueil de la reprise ou non de l’anticoagulation pendant le suivi Critères d’exclusion : - Complications non renseignées en fonction de la reprise ou non des AC - Populations mixant les HIC et hémorragies digestives - Etudes portant sur HIC post-traumatiques ou traitements chirurgicaux - Revues, éditos, lettres, études de cas, recommandations, notes techniques. - |
|
Recherche |
Medline, Ovid Embase, Cochrane Library Keywords : Anticoagulants or platelet aggregation inhibitor or atrial fibrillation or valve prosthesis or venous thromboembolism or pulmonary embolism, and intracranial hemorrhage or cerebral hemorrhage, and resum* or reinitiat* or interupt*.
|
|
Sélection |
Sélection des articles et vérification indépendante par 2 investigateurs, en cas de litige, 2 autres investigateurs.
|
|
Data |
Fiche d’extraction des données : Premier auteur, année de publication pays ou région, caractéristiques de l’étude, taille de l’échantillon, caractéristiques cliniques des patients (âge, sexe, HTA, Diabète, dyslipidémie, tabac, coronaropathie, insuffisance cardiaque, AVC), indication d’AC, type d’AC ou d’AAP, méthode diagnostique d’HIC, localisation, % de patients ayant repris le TRT AC, intervalle d’interruption, durée du suivi, perdus de vue, mortalité à long terme, Evènements thrombo-emboliques, récidive d’HIC. Evènements : Critère principal : mortalité à long terme, récidive d’HIC, complications T-E (TVP, EP, IDM, IC, embolie systémique). Critère secondaire : fréquence de réintroduction des AC, facteurs associés à la réintroduction des AC (démographiques, comorbidité, indications, co-prescription d’AAP, localisation initiale des HIC).
|
|
Risque de biais |
Evaluation du risque de biais selon la méthode la Cochrane Collaboration’s tool ou la Newcastle-Ottawa Scale (NOS).
|
|
Analyse statistique |
RR poolé, avec intervalle de confiance à 95 % Test d’homogénéité : I2, faible (25 %), modérée (50 %) ou forte (75 %) Si hétérogénéité : utilisation du modèle « random effect » Evaluation du risque de biais de publication par le Egger’s regression test, funel plots.
|
RESULTATS
Douze études sont retenues, 12 cohortes (absence de RCT), 3431 patients inclus (1141 reprenant un AC, 1500 ne reprenant pas d’AC, 790 patients sous AAP).
Cinq cent quatre-vingt-dix-huit patients décèdent durant le suivi ; 207 récidives d’HIC et 308 évènements thrombo-emboliques sont rapportés.
Les séries retenues ont été publiées de 2005 à 2016, la taille de l’échantillon varie de 20 à 1752 participants, le suivi varie de 12 à 55 mois.
Les AC utilisés sont les AVK pour toutes les séries, excepté celle de De Vleeschouwer (qui ne mentionne pas le type d’AC utilisé) et celle de Nielsen (certains participants sont sous AOD).
Reprise des AC et critère principal :
Interruption de l’anticoagulation varie de 2,5 à 124 jours après l’HIC index. 3 séries ne rapportent pas de durée exacte, 7 séries peuvent être poolées pour l’étude de la mortalité à long terme et 11 séries pour les autres évènements principaux.
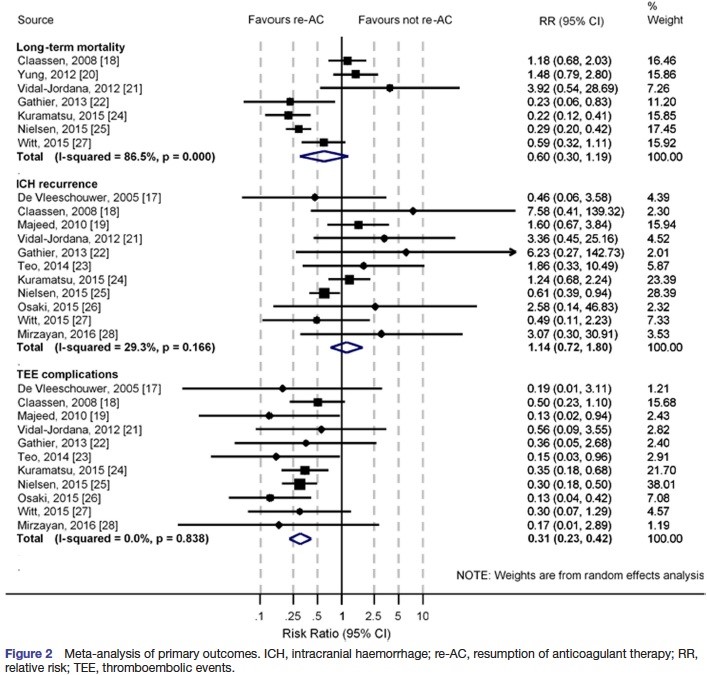
La reprise du TRT AC ne modifie pas la mortalité à long terme (RR = 0,60, IC 0,30-1,19) ou le risque de récidive d’HIC (RR = 1,14, IC 0,72-1,80) ; elle réduit par contre significativement le risque d’événement thrombo-embolique (RR = 0,31, IC 0,23-0,42).
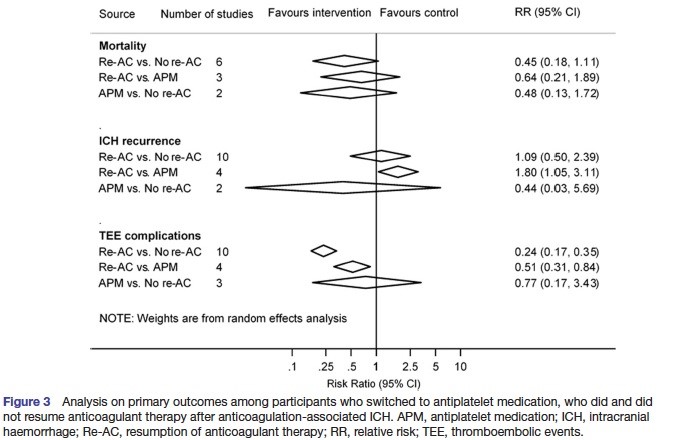
Comparé au switch vers les AAP, la reprise du TRT AC augmente le risque de récidive d’HIC (RR = 1,80, IC 1,05-3,11) mais réduit malgré tout le risque d’événement thrombo-embolique (RR = 0,51, IC 0,31-0,84), sans modification de la mortalité à long terme (RR = 0,64, IC 0,21-1,89).
Pas d’élément en faveur d’un biais de publication, excepté pour le risque de récidive d’HIC. Mais on retrouve une forte hétérogénéité dans les résultats sur la mortalité à long terme (I2 = 86,5 %) et une potentielle hétérogénéité sur les récidives d’HIC (I2 = 29,3 %, liée à l’inclusion d’HSA et d’HSD). Sur la mortalité à long terme, une étude de sous groupe des patients en FA retrouve un bénéfice à la reprise des AC (RR = 0,27, IC 0,20-0,37), sans hétérogénéité (I2 = 0,0 %).
Méta-analyse des critères secondaires :
La reprise des AC est retrouvée dans 38 % des cas (32 % à 44 %), avec une forte hétérogénéité (I2 = 89,9 %). Les indications d’AC sont la FA (31 % à 100 %), les valves prothétiques (2 % à 31 %), la MTEV (6 % à 21 %) et IC ou IDM (2 % à 18 %).
Le TRT AC est repris chez les patients avec valves prothétiques 2,52 fois plus souvent qu’en cas de FA et 2,41 fois plus souvent qu’en cas de MTEV. Le TRT AC est repris chez les MTEV 1,28 fois plus souvent qu’en cas de FA.
La reprise du TRT AC n’est pas influée par la localisation de l’HIC, excepté pour les HSA chez qui le TRT AC est repris 1,65 fois plus souvent qu’en cas d’hématome intracérébral.
DISCUSSION
Cette revue systématique avec méta-analyse met en évidence que la reprise du TRT AC après HIC sous AC réduit significativement le risque d’évènements thrombo-emboliques sans augmenter significativement le risque de récidive d’HIC et la mortalité à long terme. Ces résultats sont concordants avec 3 autres revues systématiques avec méta-analyse (Murthy SB, Stroke, 2017 ; Korompoki E, Neurology, 2017 ; Chai-Adisaksopha C, Thromb Res 2017).
Pour les patients en FA, il existe un bénéfice sur la mortalité à long terme en cas de reprise du TRT AC, ce qui est en accord avec une méta-analyse sur données individuelles (Biffi A, Ann Neurol, 2017).
Les AC sont repris plus facilement pour les valves prothétiques et les HSA. La localisation de l’HIC ne semble pas influence la décision thérapeutique de reprise des AC bien que les hématomes lobaires soient considérés comme plus à risque de récidive sous AC (Eckman MH, Stroke, 2003).
Le timing optimal de reprise des AC est incertain, une série suédoise récente rapporte un délai optimal de 7 à 8 semaines après HIC chez des patients anticoagulés pour FA (Pennlert J, Stroke, 2017) et les recommandations nord-américaines (AHA/ASA) actuellement en vigueur suggèrent qu’un délai de 4 semaines est raisonnable (valves prothétiques exclues). Pour les valves prothétiques un délai de 4 à 14 jours semble être préféré (Al Kherayf F, Thromb Res, 2016).
Le switch vers les AAP est une alternative fréquemment utilisée, il est noté dans l’étude un bénéfice en terme de récidive d’HIC, mais un bénéfice inférieur aux AC en terme d’évènements thrombo-emboliques.
Il est également noté que les AVK sont toujours les plus employés, mais que les AOD vont probablement modifier les stratégies puisqu’il semble que le risque de récidive d’HIC soit moindre qu’avec les AVK (Hernandez I, Stroke, 2017), sauf pour les valves prothétiques.
Les limites de cette revue systématique sont que dans les cohortes observationnelles, des facteurs de risque potentiels comme l’âge, la taille ou la sévérité de l’HIC ne sont pas pris en compte, et peuvent intervenir comme facteurs confondants dans le choix thérapeutique. Des biais peuvent survenir également en raison de mélange des indications d’AC, ou de série trop petites responsables d’un manque manque de puissance.
CONCLUSION
Cette étude suggère que la reprise des AC est associée à un bénéfice au plan du risque thrombo-embolique sans influence sur le risque de récidive hémorragique ou de mortalité. Ces résultats doivent être corroborés par des études randomisées contrôlées.
COMMENTAIRES
Cette revue systématique avec méta-analyse met en évidence des faits qui méritent d’être rappelés pour échafauder une conduite à tenir : tout d’abord, une mortalité à moyen / long terme au premier plan (598 / 3431, soit 17,4 % sur un suivi moyen de 2 ans), pour un taux de récidive d’HIC de 6,0 % (207 / 3431) et un taux de complication thrombo-embolique de 9,0 % (308 / 3431).
L’analyse des populations étudiées fait apparaître plusieurs situations d’hétérogénéité portant :
- sur le risque thrombo-embolique en fonction des 3 grandes indications (valves, FA, MTEV) ;
- sur le risque de récidive hémorragique en fonction de la localisation et des caractéristiques des patients (âge, niveau de PA, Diabète, microbleeds, IR, …) ;
- sur la balance bénéfice / risque de la prise en charge anti-thrombotique selon la catégorie utilisée (AVK, AAP, AOD).
L’étude met bien en évidence la disparité des risques T-E en fonction de l’indication, les valves bénéficient d’une reprise plus fréquente de l’AC avec un délai plus court, les patients en FA bénéficient d’une réduction de la mortalité avec la reprise du TRT AC. La METV est moins bien individualisée car on n’a pas d’information sur la période de survenue précoce ou tardive de l’HIC au décours du TRT AC.
Elle pêche à objectiver le risque de récidive individuel par manque de données concernant le patient et la nature de l’HIC princeps.
Elle apporte une réponse partielle sur les effets des AVK et des AAP mais manque de données suffisantes sur les AOD.
Bien qu’il soit impossible de dégager des recommandations de haut grade sur la base de résultats issus de cohortes pour la plupart rétrospectives, cette méta-analyse porte quelques enseignements : d’une part, une mortalité secondaire importante dépassant les risques de récidive hémorragique et thrombo-embolique, d’autre part, une réaffirmation du risque thrombo-embolique en l’absence de traitement anticoagulant. Enfin, bien que l’on ne puisse pas valider l’absence d’augmentation du risque de récidive hémorragique après réintroduction du TRT anticoagulant (la similitude des 2 groupes n’étant pas garantie par une quelconque randomisation) et bien qu’aucune information ne soit disponible sur l’existence d’éléments objectifs de choix, on peut retenir que le sens clinique des praticiens demeure au premier plan pour juger de la réintroduction ou non d’un traitement anti-thrombotique.
