Traitement par Apixaban de la maladie thromboembolique veineuse associée au cancer : l’étude CARAVAGGIO.
INTRODUCTION
La maladie thromboembolique veineuse (MTEV) est fréquente chez les patients cancéreux, chez lesquels le risque de récidive de MTEV et/ou de saignement rend l’utilisation des anticoagulants difficile.
Les consensus actuels (Recommandations SFMV 2019) recommandent l’utilisation des héparines de bas poids moléculaire (HBPM) pour le traitement de la MTEV associée au cancer. Les dernières recommandations internationales (ESC, ITAC-CPGs Lancet 2019) ont proposé l’utilisation du rivaroxaban ou de l’edoxaban dans ce contexte. Cependant, l’utilisation de ces anticoagulants oraux directs (AOD) est associée à un risque hémorragique accru par rapport aux HBPM notamment au niveau gastro-intestinal.
L’étude Caravaggio avait pour objectif d’évaluer si l’apixaban est non-inférieur à la daltéparine sous-cutanée dans la prévention secondaire de la récidive thromboembolique veineuse chez les patients cancéreux, et si sa prise est associée à une augmentation significative du risque de saignement majeur.
METHODES
L’étude Caravaggio est une étude contrôlée randomisée de non-infériorité, multicentrique internationale, initiée par l’investigateur, ouverte avec adjudication à l’aveugle des résultats.
Les patients cancéreux ayant un diagnostic récent de thrombose veineuse profonde proximale ou d’embolie pulmonaire, symptomatique ou de découverte fortuite, étaient éligibles pour participer à l’étude.
Hormis les carcinomes basocellulaires ou épidermoïdes, les tumeurs cérébrales primitives ou métastatiques et les leucémies aiguës, tous les cancers actifs ou diagnostiqués au cours des deux dernières années étaient éligibles à l’étude.
Les critères d’exclusion notables étaient : une espérance de vie < 6 mois, l’administration initiale d’héparine / AVK / fondaparinux > 3 jours, un score ECOG > 2, l’utilisation concomitante de forts inducteurs/inhibiteurs du cytochrome P-450 3A4 et de la Glycoprotéine-P, une insuffisance rénale sévère, l’utilisation concomitante de thiénopyridines / aspirine > 165mg/jour, un saignement actif, une défaillance hépatique, une anémie < 8g/dL, et une thrombopénie < 75G/L.
Les patients éligibles étaient assignés (randomisation de type 1:1) à recevoir pendant 6 mois : soit de l’apixaban (10mg matin et soir la première semaine puis 5mg matin et soir), soit de la daltéparine sous-cutanée (200 UI/kg/j le premier mois puis 150 UI/kg/j).
Le critère de jugement principal d’efficacité était la récidive de thrombose veineuse profonde proximale des membres inférieurs, de thrombose veineuse profonde symptomatique des membres supérieurs, d’embolie pulmonaire (symptomatique ou non), pendant les 6 mois de suivi.
Le critère de jugement principal de sécurité était la survenue de saignement majeur, qui était défini selon les critères ISTH (chute de l’hémoglobine > 2g/dL, saignement dans un site critique, nécessité d’intervention chirurgicale, saignement fatal, nécessité de transfusion d’au moins 2 culots de globules rouges) pendant toute la période de traitement et jusqu’à 72 heures après sa dernière administration.
RESULTATS
Mille cent soixante-dix patients ont été randomisés entre avril 2017 et juin 2019 dans 119 centres européens, américains et israéliens ; 576 patients ont été inclus dans le groupe apixaban (analyse en intention de traiter) et 579 patients dans le groupe daltéparine (analyse en intention de traiter).
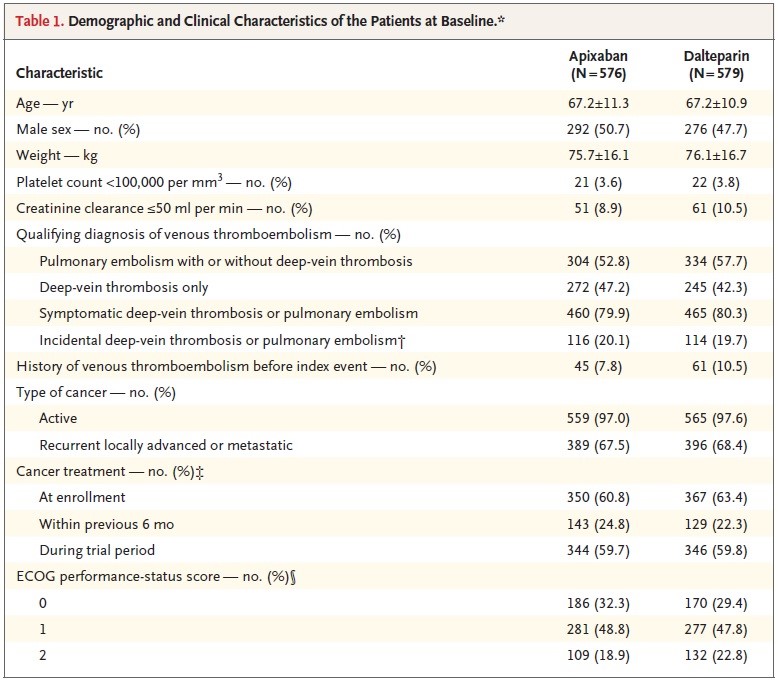
Les caractéristiques des patients étaient similaires dans les deux groupes de traitement et sont résumées dans le Tableau 1.
La durée médiane de traitement par apixaban était de 178 jours et celle du traitement par daltéparine de 175 jours.
Tableau 1 : Caractéristiques des patients à l’inclusion.
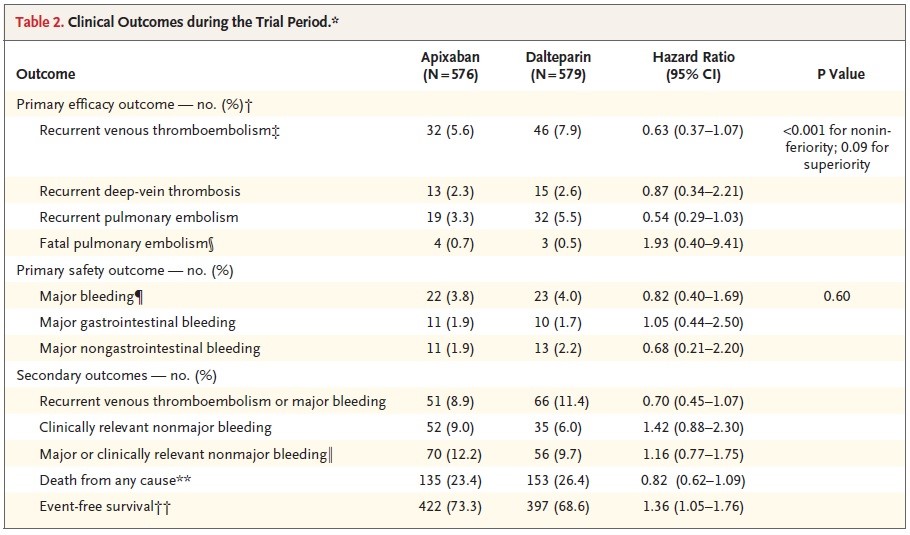
En ce qui concerne le critère de jugement principal d’efficacité, 32 patients traités par apixaban (5,6%) et 46 patients traités par daltéparine (7,6%) ont présenté une récidive thromboembolique veineuse (HR 0.63; IC95% 0.37-1.07 ; p<0.001) (Tableau 2).
En ce qui concerne le critère de jugement principal de sécurité :
- Des saignements majeurs sont survenus chez 22 patients traités par apixaban (3,8%) et 23 patients traités par daltéparine (4%) (HR 0.82; IC95% 0.40-1.69 ; p = 0.60).
- Des saignements gastro-intestinaux majeurs sont survenus chez 11 patients (1.9%) traités par apixaban et 10 patients traités par daltéparine (1.7%). Il n’y a pas eu de saignement fatal dans le groupe apixaban, il y a eu deux épisodes de saignement fatal dans le groupe daltéparine.
Parmi les critères de jugement secondaires :
- Des saignements non-majeurs cliniquement relevants sont survenus chez 52 patients (9.0%) traités par apixaban et chez 35 patients (6.0%) traités par daltéparine (HR 1.42; IC95% 0.88-2.30).
- Les décès toutes causes sont survenus chez 135 patients (23.4%) dans le groupe apixaban et chez 153 patients (26.4%) dans le groupe daltéparine. La plupart étaient liés au cancer (85.2% dans le groupe apixaban et 88.2% dans le groupe daltéparine) ; 4 décès étaient liés à la MTEV et 2 étaient liés à des complications hémorragiques dans chaque groupe de traitement.
Tableau 2 : Critères de jugement d’efficacité et de sécurité.
DISCUSSION
L’étude Caravaggio a mis en évidence une non-infériorité de l’apixaban par rapport à la daltéparine sous-cutanée dans la prévention de la récidive thromboembolique veineuse chez les patients cancéreux.
Ces résultats sont concordants avec ceux obtenus dans les études randomisées Select-D et Hokusai-VTE Cancer, qui évaluaient respectivement le rivaroxaban et l’edoxaban dans ce contexte de MTEV associée au cancer.
Les récidives thromboemboliques veineuses (et notamment des embolies pulmonaires) étaient moins importantes chez les patients traités par apixaban par rapport à ceux traités par daltéparine ; ce bénéfice non-significatif était particulièrement observé après le premier mois.
L’analyse en sous-groupe mettait en évidence une meilleure efficacité de l’apixaban par rapport à la daltéparine chez les patients de moins de 65 ans.
La fréquence des saignements majeurs (notamment d’origine gastro-intestinale) observée dans cette étude était similaire entre l’apixaban et la daltéparine. Ces résultats sont discordants des précédentes études (Select-D et Hokusai-VTE Cancer) qui mettaient en évidence une hausse des saignements chez les patients cancéreux traités par AOD par rapport à la daltéparine.
La fréquence des saignements non-majeurs était plus importante dans le groupe apixaban avec un tropisme génito-urinaire et des voies aériennes hautes.
Ces résultats ont également été retrouvés dans les précédentes études Select-D et Hokusai-VTE Cancer.
Les patients inclus avaient des cancers actifs localement avancés ou métastatiques dans 70% des cas ; parmi les cancers étudiés, les localisations étaient principalement colorectales, pulmonaires et mammaires.
Les évènements thromboemboliques veineux étaient symptomatiques dans 80% des cas.
La prise d’un traitement anti-cancéreux n’était pas un critère d’exclusion, ceux principalement utilisés étaient les anti-métabolites, les sels de platine, les anticorps monoclonaux et les hormonothérapies.
Les limites de l’étude sont multiples :
- L’étude a été réalisée en ouvert pour éviter l’utilisation sous-cutanée d’un placebo pendant 6 mois.
- La survenue d’hémorragies digestives n’était pas un critère de jugement prédéfini, mais l’a été secondairement à l’obtention des résultats des précédentes études concernant l’utilisation des AOD dans la MTEV associée au cancer.
- Le nombre de sujets inclus a été calculé afin d’obtenir une puissance suffisante pour le critère de jugement principal d’efficacité, cependant l’étude n’avait pas la puissance nécessaire pour émettre des conclusions définitives concernant le risque hémorragique. Cela s’applique notamment aux cancers du tractus gastro-intestinal haut dont la fréquence parmi les localisations cancéreuses étudiées n’était respectivement que de 4% et 5,4% dans les groupes apixaban et daltéparine.
- Les résultats de Caravaggio ne peuvent pas être appliqués au patients atteints de tumeurs cérébrales (primitives ou métastatiques connues), ainsi qu’aux patients atteints de leucémie aiguë, qui étaient exclus de l’étude.
CONLUSION
Des interrogations persistent notamment vis-à-vis de la tolérance de l’apixaban chez les patients atteints de cancers digestifs hauts ou d’hémopathies du fait des faibles effectifs étudiés, ainsi que chez les patients atteints de tumeurs cérébrales ; des travaux futurs devront être menés afin de préciser la possibilité de l’utilisation (ou non) de l’apixaban chez ces patients.
Par ailleurs, d’autres études en cours telles que Apicat permettront d’évaluer l’apixaban dans le cadre de son utilisation prolongée (après les 6 premiers mois) au sein de cette population.
